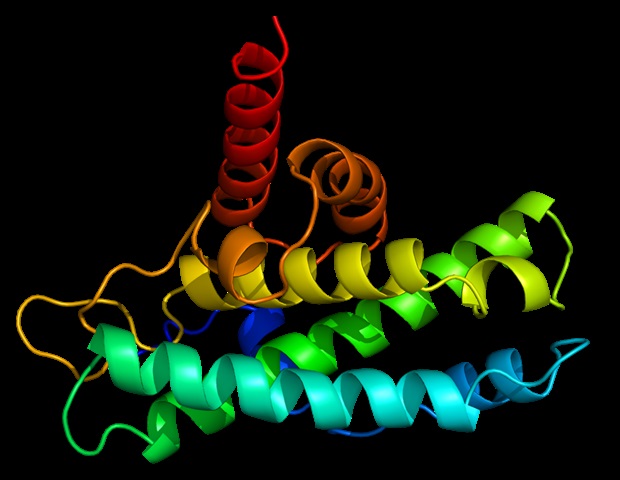
À l’intérieur des cellules, les protéines interagissent constamment les unes avec les autres pour remplir différentes fonctions. Pour certaines maladies dans lesquelles ces fonctions sont altérées, le blocage de la liaison entre deux ou plusieurs protéines apparaît comme une approche thérapeutique possible.
Des scientifiques dirigés par le chercheur de l’ICREA, le Dr Xavier Salvatella de l’IRB Barcelona, ont publié dans la revue des directives pour la conception de molécules synthétiques qui bloquent l’interaction entre deux protéines Communication Nature. En bref, les chercheurs se sont concentrés sur les interactions caractérisées par la fixation d’une hélice α de l’une des protéines à la surface de l’autre. Ce mécanisme d’interaction est très fréquent et répandu dans les fonctions cellulaires d’intérêt thérapeutique liées à des maladies telles que le cancer de la prostate.
Les lignes directrices présentées dans ce travail permettent aux scientifiques de développer des molécules de manière relativement simple qui bloquent (potentiellement) toute interaction entre une protéine globulaire et une hélice α, offrant ainsi une grande polyvalence. Ces molécules synthétiques présentent également une grande stabilité, sont solubles dans l’eau et peuvent atteindre l’intérieur de la cellule. Ces caractéristiques en font des candidats-médicaments idéaux.
Notre travail propose un moyen simple de bloquer les interactions entre les protéines globulaires médiées par les hélices α et cela peut bénéficier à la fois aux efforts d’ingénierie des protéines et de développement de médicaments. C’est une approche basée sur des recherches menées par notre laboratoire sur les interactions naturelles de certaines protéines, et elle propose d’utiliser ces connaissances pour atteindre des objectifs thérapeutiques par la conception de petites molécules aux séquences artificielles.
Dr Xavier Salvatella, responsable du laboratoire de biophysique moléculaire à l’IRB Barcelone
Concours pour un site de liaison
Lorsque deux protéines se « reconnaissent » dans la cellule et interagissent, c’est parce qu’une région de leur surface « s’emboîte », permettant ainsi la liaison. Les molécules abordées dans ce travail, comme de nombreux médicaments couramment utilisés, imitent ce site à la surface de l’une des protéines impliquées dans l’interaction, de sorte qu’elles « concourent » pour se lier au site de l’autre protéine, également appelée comme protéine cible. Ainsi, si la molécule concurrente est présente à une concentration plus élevée ou a une plus grande affinité pour la protéine cible, elle occupera tous les sites de liaison et bloquera toute interaction possible avec la protéine d’origine que le médicament imite. Cependant, la taille des grandes interfaces d’interaction des protéines rend difficile l’imitation de la surface de liaison entre elles.
« Ce que nous proposons dans ce travail, c’est de créer des molécules sous forme d’hélices α qui offrent une surface configurable pour « s’adapter » à la protéine cible, et nous expliquons comment s’assurer que cette hélice conserve une structure stable dans le contexte cellulaire », explique le Dr Albert Escobedo, actuellement chercheur postdoctoral au Centre de régulation génomique (CRG), qui a dirigé les travaux avec le Dr Salvatella à l’IRB de Barcelone.
Description des interactions et recherche d’une structure stable
Les chercheurs ont concentré leurs efforts sur le détail des caractéristiques que ces molécules synthétiques doivent réunir pour faire preuve de stabilité et pouvoir remplir leur fonction d’inhibition de l’interaction entre deux protéines. Dans l’étude, ils décrivent comment plusieurs répétitions consécutives avec un certain schéma de paires de l’acide aminé glutamine et d’un autre acide aminé hydrophobe confèrent la stabilité à l’hélice. Contrairement à d’autres approches ayant le même objectif, l’utilisation exclusive d’acides aminés naturels et l’absence de modifications chimiques pour stabiliser l’hélice peuvent améliorer la biocompatibilité et la sécurité des médicaments conçus à l’aide des nouvelles directives décrites.
Dans une autre étude publiée dans Communication Nature en 2019, les chercheurs avaient déjà observé que, pour une protéine donnée, le nombre de résidus glutamine présents dans la structure conditionnait la stabilité de sa structure en forme d’hélice. Dans cette nouvelle étude, ils ont confirmé que la même chose se produit également dans d’autres protéines, ils expliquent pourquoi et utilisent les connaissances acquises pour augmenter la polyvalence des molécules conçues. En outre, ils proposent comment des changements dans le nombre de résidus de glutamine présents dans différentes protéines peuvent provoquer différentes maladies.
Le travail a été réalisé en collaboration avec le laboratoire dirigé par le Dr Modesto Orozco à l’IRB Barcelone et des chercheurs de l’Institut de chimie avancée de Catalogne (IQAC), l’Institut Max Planck de biologie, l’Université de Barcelone (UB), le Université de Copenhague, l’Institut López Neyra de parasitologie et de biomédecine du CSIC et le CIC bioGUNE.
L’étude a été soutenue par l’Association espagnole contre le cancer, le Conseil européen de la recherche (ERC), le ministère de la Science et de l’Innovation (MICINN) et l’Agence catalane pour la gestion des subventions universitaires et de recherche (AGAUR), la Fondation Novo Nordisk , et l’Institut national de bioinformatique.