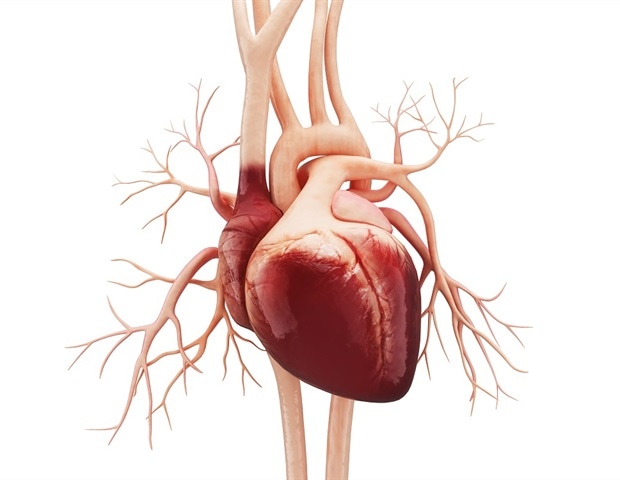
Près de 1% de tous les enfants naissent avec une cardiopathie congénitale – une gamme de problèmes potentiellement mortels avec la structure et la fonction de leur cœur. Pour la plupart des enfants, les causes précises de ces défauts effrayants sont inconnues.
Les coupables semblent être des versions anormales ou des variantes de gènes impliqués dans la formation du cœur dans l’utérus. Mais il reste encore beaucoup à apprendre sur les gènes exacts qui contribuent aux cardiopathies congénitales et sur la manière dont ils interagissent les uns avec les autres.
Maintenant, rapporté dans la revue scientifique Cellule, Des chercheurs des instituts Gladstone ont mis au point une nouvelle méthode d’identification des variantes génétiques susceptibles de jouer un rôle important dans les cardiopathies congénitales, ouvrant ainsi des possibilités d’accélérer la recherche sur cette maladie grave. L’étude a été dirigée par le président et chercheur principal de Gladstone, Deepak Srivastava, MD, et Katie Pollard, PhD, directrice du Gladstone Institute of Data Science and Biotechnology
La nouvelle stratégie – qui combine des techniques de génétique, de biologie computationnelle, de biologie des cellules souches et de protéomique – pourrait également être appliquée pour étudier de nombreuses autres maladies aux causes génétiques complexes.
« Les méthodes précédentes ont généré de longues listes de variantes détectées chez les patients, mais beaucoup se sont en fait avérées sans conséquence, donc un défi majeur dans le domaine a été d’identifier quelles variantes sont les plus importantes », explique Srivastava, qui est également cardiologue pédiatrique et un professeur au Département de pédiatrie de l’UC San Francisco (UCSF). « Notre approche identifie les variantes les plus susceptibles d’être impliquées dans la maladie, nous permettant de nous concentrer sur ces variantes, d’approfondir la compréhension de la biologie sous-jacente de la maladie et, nous l’espérons, d’évoluer plus rapidement vers de nouveaux traitements. »
Tirer parti des interactions entre les protéines
Plutôt que d’examiner les variantes de manière isolée, la nouvelle stratégie considère les interactions entre les protéines pour se concentrer sur les variantes susceptibles de causer la maladie ; dans ce cas, une cardiopathie congénitale.
Les protéines GATA4 et TBX5 étaient déjà connues pour être nécessaires à la formation d’un cœur humain sain et pour collaborer avec un réseau de protéines supplémentaires pour aider à la croissance d’un cœur. Des mutations dans les autres protéines du réseau pourraient, en théorie, contribuer à la malformation cardiaque.
Pour identifier ces gènes coupables potentiels, les chercheurs ont soigneusement cartographié l’ensemble du réseau d’interactions entre les protéines GATA4 et TBX5 en utilisant des cellules cardiaques précurseurs cultivées à partir de cellules souches pluripotentes induites par l’homme. Ensuite, ils ont croisé ce réseau de 273 protéines avec les données de séquençage de l’ADN de plus de 3 000 enfants atteints de cardiopathie congénitale et de leurs parents, développées par un consortium financé par les National Institutes of Health.
Plusieurs dizaines de variantes dans les données de séquençage des enfants correspondaient à des protéines spécifiques également trouvées dans le réseau GATA4-TBX5, bien plus que prévu, les identifiant comme des candidats susceptibles de contribuer aux cardiopathies congénitales.
« Nous avons d’abord identifié d’importants réseaux de protéines dans les types de cellules affectées par les cardiopathies congénitales, puis intégré des données de séquençage à grande échelle codant pour les protéines », déclare Bárbara González Terán, PhD, auteur principal de l’étude et chercheur postdoctoral dans l’étude de Srivastava. laboratoire. « De nombreux scientifiques avaient émis l’hypothèse que cette approche était possible, mais à notre connaissance, c’est la première fois que cela a été fait, pour une maladie. »
Découverte d’une nouvelle variante de premier plan
Déterminer si chacune des variantes candidates identifiées dans le réseau GATA4-TBX5 contribue réellement aux maladies cardiaques nécessiterait des années de recherche. Au lieu de cela, pour la dernière étape de leur nouvelle méthode, Maureen Pittman, étudiante diplômée de l’UCSF dans le laboratoire de Pollard, a développé un outil informatique qui classe les candidats en fonction de leur probabilité de contribuer à une cardiopathie congénitale. Cet algorithme de classement prend en compte les caractéristiques de la variante, le gène affecté et le type de malformation cardiaque trouvé chez les patients porteurs de la variante.
« Parmi les variantes les mieux classées que nous avons identifiées avec l’algorithme, certaines se trouvaient dans des gènes déjà connus pour contribuer aux malformations cardiaques congénitales », explique Pittman. « Mais beaucoup n’avaient jamais été liés au développement du cœur, y compris une protéine appelée GLYR1, qui est impliquée dans l’activation et la désactivation d’autres gènes. »
Des expériences supplémentaires sur des cellules et des souris ont indiqué que GLYR1 joue en effet un rôle central dans la formation du cœur, et qu’une variante patiente de GLYR1 perturbe le développement du cœur en entravant son interaction avec GATA4.
L’identification de GLYR1 comme gène clé du développement cardiaque ouvre un tout nouvel espace biologique pour comprendre le fonctionnement de ce système. Nous continuerons à étudier la biologie de GLYR1, et nous espérons que d’autres suivront les autres variantes à haut score que nous avons trouvées. »
Deepak Srivastava, MD, président de Gladstone et chercheur principal
Srivastava note que la nouvelle étude s’est fortement appuyée non seulement sur les techniques de calcul développées dans le laboratoire Pollard, mais également sur les techniques de protéomique du laboratoire de Nevan Krogan, PhD, chercheur principal à Gladstone et directeur du Quantitative Biosciences Institute de l’UCSF.
« Les efforts dynamiques et axés sur le travail d’équipe de Gladstone ont vraiment rendu cela possible », déclare Srivastava.
Un nouvel outil pour étudier les maladies complexes
Grâce aux progrès de la chirurgie, des millions d’enfants atteints de malformations cardiaques survivent maintenant jusqu’à l’âge adulte. Mais beaucoup continuent de faire face à des problèmes à vie, comme un risque accru d’insuffisance cardiaque.
« Une meilleure compréhension de la base génétique de la cardiopathie congénitale pourrait indiquer de nouvelles stratégies non seulement pour bloquer le développement de la maladie, qui est actuellement très difficile, mais aussi pour atténuer les problèmes qui persistent après la chirurgie afin d’améliorer la qualité et la durée de vie », déclare González Terán.
Les chercheurs pensent que la puissance de leur nouvelle méthode réside dans sa promesse d’aider à éclairer la manière dont des combinaisons de variantes, plutôt que des variantes uniques, fonctionnent ensemble pour provoquer une cardiopathie congénitale.
« Cette maladie est rarement causée par un seul gène ; un patient porteur de la variante GLYR1, par exemple, pourrait peut-être avoir des variantes supplémentaires héritées de ses parents qui, à elles seules, n’étaient pas suffisantes pour provoquer la maladie, mais le font parallèlement à la variante GLYR1 », explique Pollard, qui est également professeur à l’UCSF et enquêteur de Chan Zuckerberg Biohub. « Notre nouvelle approche pourrait aider à identifier des combinaisons spécifiques de variantes qui causent des malformations cardiaques. »
Cette méthode pourrait également être adaptée pour identifier des combinaisons de variantes qui peuvent sous-tendre d’autres maladies complexes. Par exemple, l’équipe de Pollard cherche déjà à l’appliquer aux troubles neurodéveloppementaux, notamment l’autisme et l’épilepsie.
« Avec de plus en plus de données de séquençage générées chaque année à partir de patients atteints de maladies complexes, notre approche aidera à déterminer où se concentrer parmi toutes les variantes détectées », déclare Srivastava.