PerkinElmer, Inc., un leader mondial engagé à innover pour un monde plus sain, a annoncé aujourd'hui que la Food and Drug Administration (FDA) des États-Unis avait accordé une autorisation d'utilisation d'urgence (EUA) pour le nouveau test RT-PCR de Coronavirus de la société. Les laboratoires cliniques certifiés en vertu des modifications de l'amélioration des laboratoires cliniques (CLIA) peuvent immédiatement commencer à utiliser ce kit pour détecter le SRAS-CoV-2, le virus qui cause le COVID-19.

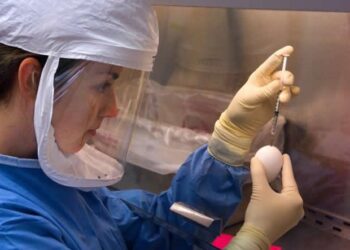
Nouveau test RT-PCR de Corkinavirus de PerkinElmer (Photo: Business Wire)
Le test RT-PCR de PerkinElmer est commercialisé en tant que dispositif de diagnostic in vitro (DIV) en répondant aux exigences de la directive européenne de diagnostic in vitro (DIV) et est disponible dans plus de 30 pays à travers le monde.
«Malgré l'environnement difficile, nos employés ont fait preuve d'un engagement indéfectible au cours des deux derniers mois pour lutter contre cette pandémie mondiale», a déclaré Prahlad Singh, président et chef de la direction, PerkinElmer. «L’ampleur de la solution globale de workflow de PerkinElmer nous place dans une position unique pour répondre rapidement aux besoins de nos clients en diagnostic clinique.»

























Comment un sommeil de qualité peut réduire le risque de maladie cardiaque et d’accident vasculaire cérébral