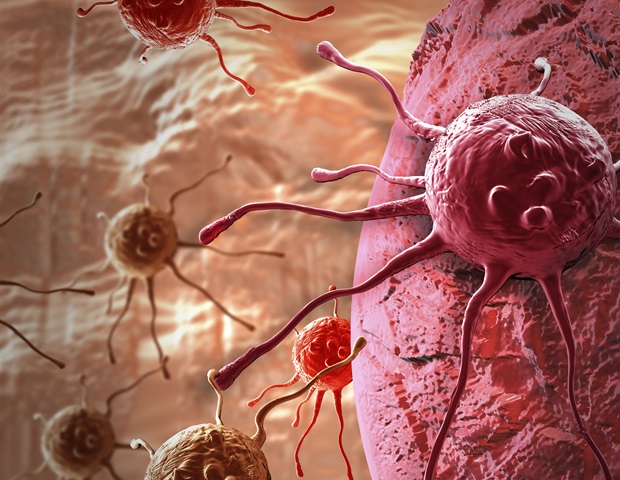
Des chercheurs du Baylor College of Medicine ont découvert un régulateur crucial de la réponse immunitaire anticancéreuse qui pourrait changer la donne dans la lutte contre le cancer. Publié dans le Actes de l’Académie nationale des sciences, l’étude montre que dans des modèles animaux de cancer du sein et de la prostate, l’élimination du gène SRC-3, spécifiquement dans un type de cellule immunitaire appelée cellules T régulatrices (Tregs), a déclenché une réponse anticancéreuse à vie qui a éradiqué la tumeur sans le côté typique effets observés avec d’autres thérapies.
De plus, le transfert de Tregs sans SRC-3 à des animaux porteurs de tumeurs cancéreuses du sein a également entraîné une élimination à long terme de la tumeur sans effets secondaires négatifs. Les résultats encouragent la poursuite d’enquêtes supplémentaires pour déterminer la valeur de cette approche pour traiter la maladie humaine.
Il y a plus de 30 ans, mon laboratoire a découvert une protéine appelée coactivateur des récepteurs stéroïdiens (SRC) qui est nécessaire à la régulation efficace de l’activité des gènes. Depuis lors, nous avons découvert qu’une famille de SRC (SRC-1, SRC-2 et SR-3) régule l’activité d’une variété de fonctions cellulaires. »
Dr Bert W. O’Malley, auteur correspondant, chancelier et professeur de biologie moléculaire et cellulaire à Baylor
Au fil des ans, le laboratoire O’Malley et ses collègues se sont particulièrement intéressés au SRC-3 et à son rôle dans le cancer. SRC-3 est non seulement fortement exprimé dans tous les cancers humains et joue un rôle dans la croissance du cancer, mais il est également fortement exprimé dans les Treg qui régulent la réponse immunitaire au cancer. Intrigués par l’abondance de SRC-3 dans les Tregs et soupçonnant qu’il pourrait jouer un rôle dans le contrôle de la progression du cancer, O’Malley et ses collègues ont étudié l’effet de l’élimination du gène SRC-3 dans les Tregs sur la croissance du cancer du sein.
L’équipe a généré des souris dépourvues du gène SRC-3 uniquement dans les Tregs (inactivation de SRC-3), puis a comparé la progression du cancer du sein chez ces souris avec la progression chez les souris porteuses du gène SRC-3.
« Nous avons été surpris par les résultats », a déclaré O’Malley. « Les tumeurs du sein ont été éradiquées dans les knock-out SRC-3. Une injection ultérieure de cellules cancéreuses supplémentaires chez ces souris n’a pas donné lieu à de nouvelles tumeurs, ce qui montre qu’il n’était pas nécessaire de générer des cellules supplémentaires. SRC-3 knock-out pour maintenir la résistance tumorale. Il est important de noter que le transfert de ces cellules à des animaux porteurs de tumeurs mammaires préétablies a également entraîné l’éradication du cancer. Nous avons obtenu des résultats similaires avec le cancer de la prostate. »
L’équipe a également découvert que les Tregs dépourvus de SRC-3 médiaient l’éradication durable de la tumeur en modifiant efficacement l’environnement entourant la tumeur en un environnement qui favorisait son élimination.
En utilisant une variété de techniques de laboratoire, O’Malley et ses collègues ont découvert que les Tregs modifiés proliféraient largement et infiltraient préférentiellement les tumeurs du sein où ils libéraient des composés qui généraient une réponse immunitaire anti-tumorale. D’un côté, les composés facilitaient l’entrée des cellules immunitaires – cellules T et cellules tueuses naturelles – qui attaquaient directement la tumeur et, de l’autre côté, les Tregs modifiés bloquaient d’autres cellules immunitaires qui tentaient d’arrêter la réponse anti-tumorale.
« D’autres traitements publiés semblent réduire la charge tumorale ou éliminer le cancer pendant un certain temps, mais dans la plupart des cas, il revient. Nos découvertes dans des modèles animaux sont les premières à montrer que les Tregs dépourvus de SRC-3 éradiquent les tumeurs cancéreuses établies et semblent conférer à long- une protection durable contre les récidives », a déclaré le premier auteur, le Dr Sang Jun Han, professeur agrégé de biologie moléculaire et cellulaire et au Centre de médecine reproductive de Baylor. Il est également membre du Dan L Duncan Comprehensive Cancer Center de Baylor. « Nous sommes très enthousiasmés par les résultats ; dans l’ensemble, ils justifient la poursuite de nos recherches pour traduire les découvertes en une thérapie anticancéreuse nouvelle, plus efficace et plus durable. »
D’autres contributeurs à ce travail incluent les scientifiques seniors David M. Lonard et Cliff C. Dacso et les membres du laboratoire Prashi Jain, Yosef Gilad, Yan Xia, Nuri Sung, Mi Jin Park, Adam M. Dean, Rainer B. Lanz, Jianming Xu, tous à Baylor.
Ce travail est en partie soutenu par le financement des subventions des National Institutes of Health R01HD07857, R01HD08188 et R01HD098059 et CoRegen, Inc.
Baylor s’est associé à CoRegen, Inc. pour commercialiser ces découvertes révolutionnaires. Tous les brevets et la propriété intellectuelle sous-jacents à ces découvertes ont été concédés sous licence à CoRegen, Inc. (www.coregeninc.com)