Une équipe dirigée par des chercheurs du centre médical du sud-ouest de l’UT a découvert une protéine qui semble être essentielle à l’ossification hétérotopique traumatique (HO), une condition dans laquelle l’os se forme dans les muscles, les tendons et d’autres tissus mous après une blessure traumatique ou une intervention chirurgicale. Les conclusions, publiées dans Avancées scientifiquespourraient offrir de nouvelles façons de prévenir cette complication courante, selon les chercheurs.
À l’heure actuelle, nous n’avons aucun moyen d’empêcher l’OH de se produire, ce qui peut entraîner des altérations importantes de la qualité de vie. Par exemple, il peut altérer l’amplitude des mouvements des patients, produire des douleurs chroniques et affecter la capacité des amputés à s’adapter aux prothèses. Espérons que ces nouvelles découvertes conduiront à des traitements qui peuvent empêcher ce processus de se dérouler afin que les patients ne le développent jamais. »
Benjamin Levi, MD, professeur agrégé de chirurgie et de chirurgie plastique, et chef de la division de chirurgie des brûlures, des traumatismes, des soins aigus et des soins intensifs à UT Southwestern
L’HO se produit lorsque des cellules qui servent de précurseurs à divers tissus du système musculo-squelettique se développent anormalement en os et/ou en cartilage après une intervention chirurgicale, comme une arthroplastie ou des blessures traumatiques, comme les blessures par explosion des anciens combattants, les blessures à la tête, les brûlures et les articulations. luxations. Jusqu’à 50% des patients qui subissent une arthroplastie totale de la hanche développent une HO, a déclaré Chase A. Pagani, un MD / Ph.D. de l’UT Southwestern. étudiant du laboratoire Levi qui a co-dirigé l’étude avec le Dr Levi.
Malgré la fréquence élevée de HO, a expliqué M. Pagani, on sait peu de choses sur comment ou pourquoi il se développe. Après avoir observé qu’il se produit fréquemment autour des articulations, les membres du laboratoire Levi ont mené des recherches antérieures montrant que l’immobilisation des articulations dans des modèles animaux atteints de cette maladie réduisait considérablement la formation osseuse en empêchant les fibres de collagène entourant la blessure de s’aligner. Bien que ces découvertes suggèrent que l’HO se produit à partir d’une interaction entre les cellules précurseurs et le collagène, le mécanisme moléculaire sous-jacent reste un mystère.
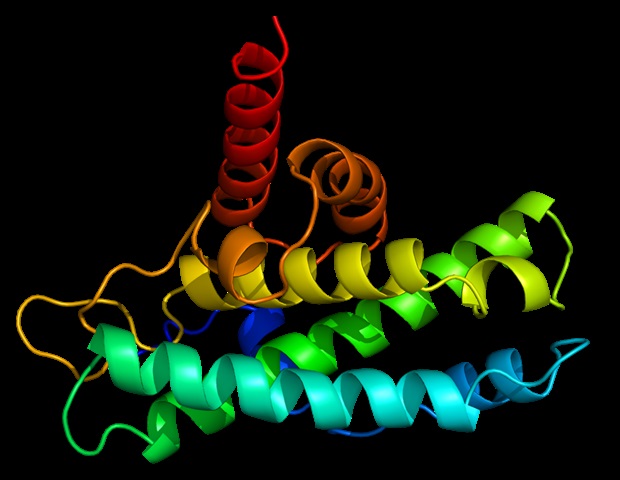
Pour mieux comprendre l’HO, le Dr Levi, M. Pagani et leurs collègues ont prélevé des cellules des tendons d’Achille de souris de laboratoire avant l’induction de l’HO, puis une et trois semaines après l’induction. Lorsqu’ils ont examiné l’activité des gènes des cellules, ils se sont concentrés sur un gène appelé DDR2, qui produit une protéine connue sous le nom de récepteur de domaine discoïdine 2 (DDR2). Cette protéine, qui se trouve à la surface des cellules, lie le collagène et a été liée à la formation des os et du cartilage.
Lorsque les chercheurs ont supprimé la DDR2 par des techniques génétiques ou l’ont inactivée en traitant les souris avec un médicament, la formation de HO a considérablement diminué. Un examen plus approfondi du collagène entourant le HO a montré que l’élimination de cette protéine empêchait les fibres de collagène de s’aligner, tout comme l’immobilisation des articulations l’avait fait dans l’étude précédente.
Ces résultats montrent que la DDR2 est un acteur crucial pour l’HO traumatique, a déclaré le Dr Levi. Le médicament utilisé pour supprimer cette protéine dans l’étude est approuvé par la FDA pour traiter le cancer, et d’autres médicaments en développement pourraient offrir un ciblage plus spécifique de la DDR2, ce qui suggère qu’une prévention et/ou un traitement efficace de l’HO peut déjà exister.
Le Dr Levi est titulaire de la chaire Dr Lee Hudson-Robert R. Penn en chirurgie. Il est également membre du Children’s Medical Center Research Institute de l’UT Southwestern et du Charles and Jane Pak Center for Mineral Metabolism and Clinical Research.
Parmi les autres chercheurs de l’UTSW qui ont contribué à cette étude figurent Alec C. Bancroft, Robert J. Tower, Nicholas Livingston, Yuxiao Sun, Jonathan Y. Hong, Johanna H. Nunez, Jessica Marie R. Medrano, Benjamin A. Nanes et Kevin M. Doyen.

























L'étude met en valeur comment l'âge affecte la réponse des cellules nasales au SRAS-CoV-2